Є надія, що таки вдасться побороти онкоген, який не піддавався нам протягом останніх 30-ти років.
Описано новий шлях активації онкогену KRAS в клітинах раку підшлункової залози
Зображення взято з cancer.gov
Знайдено нову спадкову форму раку. Мутація, яка призводить до захворювання може стати мішенню для цільвої терапії (target therapy).
В дослідженні, опублікованому в журналі Nature Genetics (серпень 2019), описується випадок родинної дуктальної аденокарциноми підшлункової залози (ДАПЗ). Цей тип раку виникає з клітин епітелію протоків підшлункової залози і є найбільш поширеною онкологією цього органу. Приблизно 10 % випадків ДАПЗ мають явну спадкову компоненту – зустрічаються протягом декількох поколінь в деяких родинах. Але до сьогодні не було відомо які саме гени задіяні у формуванні цього злоякісного новоутворення.
Вчені проаналізували повні геноми членів родини зі спадковою ДАПЗ і виявили одну мутацію, яка з високою ймовірністю корелювала із онкологічним захворюванням. Для того щоб підтвердити біологічну роль мутації дослідники використали клітинну та тваринну експериментальну моделі. Спочатку вони внесли мутацію до геному культури клітин людини (HEK 293) і спостерігали їх активніший ріст в чашці Петрі порівняно із немодифікованим контролем. Надалі вони помістили мутацію в контекст цілого організму, використавши для цього спеціально виведені лабораторні лінії рибок Даніо реріо: у рибок, що несли мутацію, пухлини розвивалися скоріше і досягали більших розмірів.
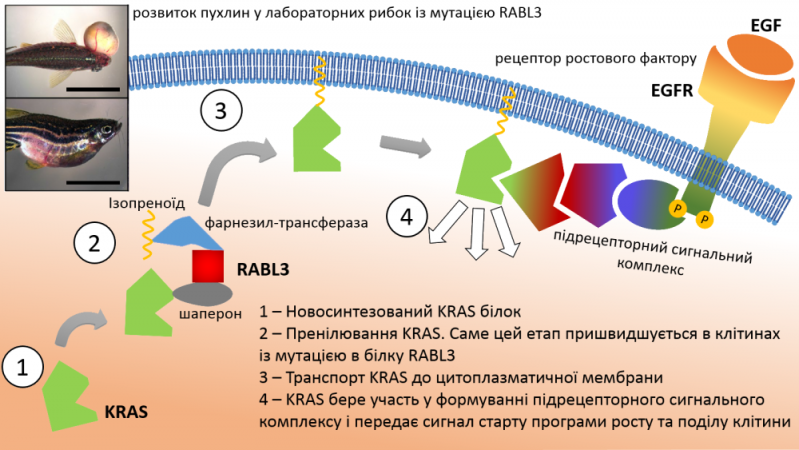
Мутація, яку виявили вчені, призводила до вкорочення білкового продукту гену RABL3 (так звана нон-сенс мутація, що призводить до появи стоп-кодону і передчасного завершення синтезу білка на рибосомі). Цікаво, що функція цього протеїну до сьогодні не була відома. Тому дослідникам довелося висвітлювати цей аспект проблеми. Вони провели додаткові експерименти для визначення білків-партнерів, які взаємодіють із RABL3 (застосовувалися методи транскриптоміки, афінної мас-спектрометрії, ко-імуно-преципітації, флуоресцентної мікроскопії, кондиційного нокаутування білків-партнерів та біохімічного блокування пренілювання). Було встановлено, що RABL3 задіяний в активації онкогену KRAS, порушення в якому спостерігають у великій кількості злоякісних новоутворень та у переважній більшості спонтанних випадків раку підшлункової залози. Так, мутантний RABL3 значно прискорював пренілювання KRAS, що є одніє з умов його активації.
Білок KRAS – один з трьох членів родини білків Ras (назва походить від об’єкту на якому вивчали даний ген – саркома щурів – rat sarcoma). Ці білки експресуються в усіх тканинах організму і задіяні у передачі сигналу, що спонукає клітину до росту і поділу (проліферації). Порушення Ras-сигналювання є одним із чинників неопластичної трансформації клітини, тому вони є потенційними онкогенами. Ключовим етапом активації KRAS є пренілювання – спеціальний ензим додає до протеїну молекулу ізопреноїду довжиною у 15 атомів вуглецю. Оскільки ізопреноїд – жиророзчинний (гідрофобний), він слугує своєрідним гачком, за допомогою якого білок KRAS чіпляється за внутрішню поверхню цитоплазматичної мембрани клітини, де KRAS бере участь у формуванні і сигнального комплексу безпосередньо під рецептором, який передає сигнал всередину клітини (у випадку KRAS – це тирозин-кіназний рецептор до ендотеліального ростового фактору, EGFR). Відтак, мутантний RABL3 пришвидшує темпи пренілювання KRAS, що в свою чергу веде до посилення проліферативного сигналу і може викликати перетворення клітини на ракову.
Загалом, це дуже міцна експериментальна робота – взірець мультидисциплінарного підходу: почалася з пошуку онкогенної мутації методами біоінформатики та статистики, продовжилася перевіркою її біологічних ефектів in vitro та in vivo та завершилася характеризацією наслідків мутації на молекулярному рівні в клітині. У підсумку дослідження допомогло виявити ще одне вразливе місце онкологічного захворювання – раку підшлункової залози, що в майбутньому дозволить розробити нові підходи до терапії цього злоякісного новоутворення. Причому ці результати будуть корисні не дише для членів родин зі спадковою формою ДАПЗ, а і для пацієнтів без родинної історії цього захворювання, оскільки ті ж самі мутації можуть виникати спонтанно.
Застосування системи геномного редагування CRISPR/Cas9 для швидкого моделювання канцерогенезу
 Канцерогенез – багатостадійний процес. В загальних рисах його поділяють на ініціацію, промоцію та прогресію. Кожний з етапів характеризується набуттям специфічних мутацій в генах, що відіграють ключову роль в розвитку пухлин, головно – прото-онкогенах та генах-супресорах пухлинного росту. Дослідження індивідуального внеску кожного з таких генів у «спільній справі», результатом якої є злоякісне новоутворення, є вкрай проблемним. На сьогодні існують дуже ефективні методи секвенування геному, настільки чутливі, що дозволяють визначати якісну та кількісну структуру генів окремої клітини. Такі методи активно застосовуються для дослідження гетерогенності популяції пухлинних клітин і є інформативними для вивчення пізніх стадій канцерогенезу. Проте, вони дають лише підсумкову картинку і не дозволяють прослідкувати історію мутацій і роль кожної з них на ранніх етапах неопластичної трансформації.
Канцерогенез – багатостадійний процес. В загальних рисах його поділяють на ініціацію, промоцію та прогресію. Кожний з етапів характеризується набуттям специфічних мутацій в генах, що відіграють ключову роль в розвитку пухлин, головно – прото-онкогенах та генах-супресорах пухлинного росту. Дослідження індивідуального внеску кожного з таких генів у «спільній справі», результатом якої є злоякісне новоутворення, є вкрай проблемним. На сьогодні існують дуже ефективні методи секвенування геному, настільки чутливі, що дозволяють визначати якісну та кількісну структуру генів окремої клітини. Такі методи активно застосовуються для дослідження гетерогенності популяції пухлинних клітин і є інформативними для вивчення пізніх стадій канцерогенезу. Проте, вони дають лише підсумкову картинку і не дозволяють прослідкувати історію мутацій і роль кожної з них на ранніх етапах неопластичної трансформації.
В наші дні з’явилася безпрецедентна можливість слідкувати за онкогенними мутаціями в режимі реального часу за допомогою…
Молекулярний механізм загоювання ран залучений в резистентності раку сечового міхура до хіміотерапії
З часу, коли знаний американський онколог Гарольд Дворак порівняв пухлину із “раною, що ніколи не загоюється”, пройшло вже майже тридцять років, а така аналогія досі є як актуальною, так і не до кінця зрозумілою. Вчені Baylor College of Medicine (Х’юстон, США) описали шлях, який призводить до набуття резистентності до хіміотерапії раку сечового міхура. Оскільки таргетні препарати для лікування цього типу пухлин ще не розроблені, то на сьогодні способи протидії зводяться лише до хірургічного видалення та неспецифічної цитотоксичної хіміотерапії. Такі підходи дозволяють швидко зменшити пухлинну масу, але зазвичай тривалість ремісій не є оптимальною, і хвороба скоро повертається. Обидва зазначені вище методи лікування є доволі травматичними для тканин організму і пов’язані з вивільненням специфічних молекул, які сигналізують запалення та запускають каскади відповіді на пошкодження, результатом чого за норми є загоювання рани. Але, оскільки рак – стан патологічний – нормального загоювання не відбувається. Однією з таких сигнальних молекул є простагладин Е2 (PGE2), рівень якої значно підвищується у пацієнтів, які проходять циклічні курси хіміотерапії та/або були прооперовані. Техаським вченим вдалося встановити, що PGE2 взаємодіє із рецепторами на поверхні спочиваючих ракових стовбурових клітинах (quiescent cancer stem cells) і активує їх проліферацію точнісінько так само, як це відбувається за норми із стромальними стовбуровими клітинами, які заповнюють собою проріху, що утворилася внаслідок пошкодження. Проте злоякісні клітини характеризуються численними мутаціями, тому некоректно поводять себе під час цього процесу. Зокрема, відомо, що ракові клітини позбавлені контактного інгібування, тож продовжують розмножуватися, навіть тоді, коли за норми мали б припини це робити. Таким чином, пухлина використовує природний процес для своєї експансії, а хіміотерапія лише діє як селективний агент. Дослідницька група Baylor College of Medicine пропонує спосіб розірвати це порочне коло шляхом застосування специфічного інгібітора циклооксигенази-2 (COX2) під назвою целекоксіб (celecoxib). Він здатний ефективно пригнічувати PGE2-опосередковане сигналювання загоювання ран, що по ідеї повинно тримати під контролем стовбурові клітини раку. Вивчення ксенотрансплантатів пухлин сечового міхура на мишачих моделях in vivo підтвердило можливість стримування пухлинного росту за допомогою целекоксібу. Також гарною новиною є те, що згаданий вище терапевтичний препарат вже стверджений Управлінням продовольства і медикаментів (Food and Drug Administration, FDA), що дозволить значно полегшити і прискорити його клінічні випробовування і впровадження в якості схеми терапії раку сечового міхура.
Посилання
Агенти впливу пухлини: злоякісні екзосоми
 Дедалі більшої уваги набуває відносно нещодавно описаний феномен дистанційної взаємодії пухлини зі здоровими тканинами організму через секрецію екзосом. Деякі злоякісні клітини здатні до виділення у міжклітинний простір та тілесні рідини наноскопічні везикули – кулясті мішечкі, оточені плазматичною мембраною, які можуть містити різноманітні активні речовини, здатні впливати на фізіологічні процеси, що проходять всередині нормальних клітин. Вчені припускають, що таким чином трансформовані клітини можуть впливати на оточуючі тканини і програмувати їхню діяльність на підтримання пухлини. Зокрема у 2012 році вчені Університету Штату Огайо продемонстрували здатність пухлин пригнічувати імунну відповідь за допомогою екзосом, що містили мікроРНК. А нещодавнє дослідження вчених Техаського Університету виявило взагалі неймовірні речі: біогенез мікроРНК може автономно проходити у везикулах, а потрапляння їх вмісту в нормальні епітеліальні клітини може призводити до їхнього неопластичного переродження. Фактично, отримано ще один доказ того, що «рак» може передаватися від клітини до клітини.
Дедалі більшої уваги набуває відносно нещодавно описаний феномен дистанційної взаємодії пухлини зі здоровими тканинами організму через секрецію екзосом. Деякі злоякісні клітини здатні до виділення у міжклітинний простір та тілесні рідини наноскопічні везикули – кулясті мішечкі, оточені плазматичною мембраною, які можуть містити різноманітні активні речовини, здатні впливати на фізіологічні процеси, що проходять всередині нормальних клітин. Вчені припускають, що таким чином трансформовані клітини можуть впливати на оточуючі тканини і програмувати їхню діяльність на підтримання пухлини. Зокрема у 2012 році вчені Університету Штату Огайо продемонстрували здатність пухлин пригнічувати імунну відповідь за допомогою екзосом, що містили мікроРНК. А нещодавнє дослідження вчених Техаського Університету виявило взагалі неймовірні речі: біогенез мікроРНК може автономно проходити у везикулах, а потрапляння їх вмісту в нормальні епітеліальні клітини може призводити до їхнього неопластичного переродження. Фактично, отримано ще один доказ того, що «рак» може передаватися від клітини до клітини.
«Молекулярний КітПес» викликає агресивний рак головного мозку
 Масштабне дослідження агресивного раку головного мозку, гліобластоми, дозволило виявити новий тип химерного онкогену, утвореного внаслідок хромосомної транслокації. Така генетична аномалія призводить до злиття воєдино двох протеїнів PTPRZ1 та MET із протилежними функціями, нагадуючи героя, а точніше героїв, популярного колись мультфільму «КітПес». Вчені сподіваюся, що їхнє відкриття може стати підґрунтям для розробки цілеспрямованої терапії проти цієї недуги. Але окрім відкриття теоретичної можливості запровадження таргетної терапії гліобластоми, дослідження також вказує на значний недолік сучасного терапевтичного підходу, довгостроковим результатом якого є прогресія злоякісного захворювання.
Масштабне дослідження агресивного раку головного мозку, гліобластоми, дозволило виявити новий тип химерного онкогену, утвореного внаслідок хромосомної транслокації. Така генетична аномалія призводить до злиття воєдино двох протеїнів PTPRZ1 та MET із протилежними функціями, нагадуючи героя, а точніше героїв, популярного колись мультфільму «КітПес». Вчені сподіваюся, що їхнє відкриття може стати підґрунтям для розробки цілеспрямованої терапії проти цієї недуги. Але окрім відкриття теоретичної можливості запровадження таргетної терапії гліобластоми, дослідження також вказує на значний недолік сучасного терапевтичного підходу, довгостроковим результатом якого є прогресія злоякісного захворювання.
Подолання негативних побічних наслідків таргетної терапії інгібіторами тирозинкіназ
Хоча на сьогодні тирозинкіназні інгібітори є передовим методом терапії багатьох онкологічних захворювань, досі залишається невирішеним питанням негативного впливу інгібіторів на здорові тканини пацієнта. Відомо що, такі препарати здатні викликати широкий спектр побічних наслідків. Найбільш серйозним є їхній вплив на систему кровотворення: вони можуть викликати анемію, тромбопенію та нейтропенію – оскільки клітини гемопоезу та імунної системи здебільшого спираються на тирозинкіназні сигнальні каскади проліферації. Разом із тим відзначаються також порушення функціонування епітеліїв, зокрема висипання та набряки шкіри, фолікуліт, а також розлади травлення такі як діарея та нудота. Ще остаточно не з’ясовані наслідки довготривалого застосування інгібіторів тирозинкіназ, але вважається, що серед таких може бути серцева недостатність. Тому розробка інгібіторорів тирозинкіназ, які б набували активної форми безпосередньо в клітині раку, наразі є перспективним завданням протиракової фармакології.

Ілюстрація принципу селективної активації тирозинкіназного інгібітора в клітині раку. Ліва частина – в клітині із нормальним постачанням кисню модифікована форма молекули містить кобальт (ІІІ) і її стеріометрія не дозволяє зв’язатися та інактивувати тирозинкіназний домен рецептору EGFR. Права частина – так як пухлина перебуває в гіпоксійних умовах, а відтак перенасичена відновними еквівалентами, відбувається так звана біоредукція кобальту в складі молекули, його вивільнення, відновлення конформації молекули та інгібування тирозинкіназного домену рецептору EGFR.
Вчені вдарили по слабкому місцю пухлини: індукція оксидативного стресу в клітинах раку легень
Клітини раку є сенсибілізованими до оксидативного стресу через певні особливості метаболізму, і якщо їх трошечки підштовхнути в бік продукції реактивних форм кисню – вони приречені на смерть, чи бодай зупинку проліферації. Таку тезу демонструє нам дослідження американських вчених UT Southwestern Medical Center, яким вдалося спинити розмноження клітин раку легенів застосувавши звичайний антидіабетичний препарат. Але за таким здавалось би простим підходом стоять роки кропіткої наукової роботи і сучасна методологічна база, що знадобилися для розкриття молекулярного механізму дії цього препарату.

Загальна схема експерименту та основні отримані результати. Деталі у тексті, посилання наприкінці.
Українська протиракова вакцина на марші
На написання цієї статті мене підштовхнув новинний сюжет, який нещодавно з’явився у Фактах ICTV. В ньому розповідається про передову розробку українських вчених в галузі імунотерапії раку, що допомагає подовжити період безрецедивного виживання пацієнтів після хірургічного видалення пухлини. Наразі я пропоную переглянути сюжет, а далі перейти до безпосереднього обговорення того, що, власне, відбувається на молекулярному та клітинному рівні:
Епічна битва: Сибірська виразка проти раку
Зазвичай, коли у дослідника бракує уяви щось придумати самотужки, він звертається за порадою до наймогутнішого інженера у всесвіті – до природи. Саме цю ключову істину ілюструє нам дана дослідницька історія. В терапії злоякісних новоутворень є прогалина, яку ще нікому не вдалося заповнити – «адресна доставка» терапевтичної речовини до клітини раку. Успіх таргетної трапії (недоліки якої ми мали можливість обговорювати раніше) зумовлений насамперед тим, що активана молекула діє у рази ефективніше саме у перероджених клітинах. Але разом із тим вона потрапляє до здорових тканин організму, де може спричинювати неспецифічні ефекти терапії (так звані off-target effects, термін запозичений з досліджень РНК інтерференції), які варіюють у широких межах в залежності від типу препарату та індивідуальних особливостей пацієнта. Тому цілеспрямована доставка протиракових агентів є “святим граалем” сучасної молекулярної онкології. Десятиліттями вчені намагалися вирішити цю проблему. Спочатку надії покладали на ліпосоми. Вони хоч і були доволі ефективними для перекидання терапевтичних молекул через цитоплазматичну мембрану, і навіть могли бути прицільно спрямовані шляхом кон’югації антитіл, проте виявляли потужний гепатотоксичний вплив на експериментальних моделях in vivo, тому вони навіть не дійшли до стадії клінічних випробувань. Були також подібні розробки, які оминали використання ліпосом (полімерні та композитні наночастки, пенетруючі пептиди, трансактиватор транскрипції вірусу імунодефіциту людини, це лише неповний перелік), але вірогідність подолання цитоплазматичного бар’єру терапевтичною молекулою в такому разі значно зменшувалася.