Є надія, що таки вдасться побороти онкоген, який не піддавався нам протягом останніх 30-ти років.
Tag Archives: онкоген
Описано новий шлях активації онкогену KRAS в клітинах раку підшлункової залози
Зображення взято з cancer.gov
Знайдено нову спадкову форму раку. Мутація, яка призводить до захворювання може стати мішенню для цільвої терапії (target therapy).
В дослідженні, опублікованому в журналі Nature Genetics (серпень 2019), описується випадок родинної дуктальної аденокарциноми підшлункової залози (ДАПЗ). Цей тип раку виникає з клітин епітелію протоків підшлункової залози і є найбільш поширеною онкологією цього органу. Приблизно 10 % випадків ДАПЗ мають явну спадкову компоненту – зустрічаються протягом декількох поколінь в деяких родинах. Але до сьогодні не було відомо які саме гени задіяні у формуванні цього злоякісного новоутворення.
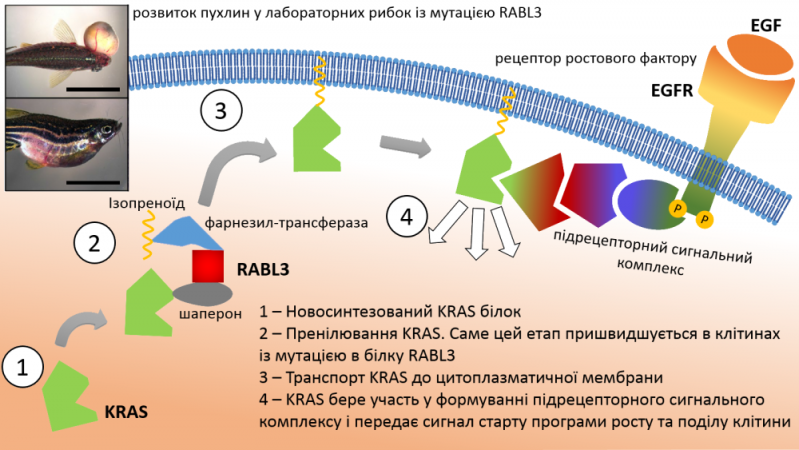
Вчені проаналізували повні геноми членів родини зі спадковою ДАПЗ і виявили одну мутацію, яка з високою ймовірністю корелювала із онкологічним захворюванням. Для того щоб підтвердити біологічну роль мутації дослідники використали клітинну та тваринну експериментальну моделі. Спочатку вони внесли мутацію до геному культури клітин людини (HEK 293) і спостерігали їх активніший ріст в чашці Петрі порівняно із немодифікованим контролем. Надалі вони помістили мутацію в контекст цілого організму, використавши для цього спеціально виведені лабораторні лінії рибок Даніо реріо: у рибок, що несли мутацію, пухлини розвивалися скоріше і досягали більших розмірів.
Мутація, яку виявили вчені, призводила до вкорочення білкового продукту гену RABL3 (так звана нон-сенс мутація, що призводить до появи стоп-кодону і передчасного завершення синтезу білка на рибосомі). Цікаво, що функція цього протеїну до сьогодні не була відома. Тому дослідникам довелося висвітлювати цей аспект проблеми. Вони провели додаткові експерименти для визначення білків-партнерів, які взаємодіють із RABL3 (застосовувалися методи транскриптоміки, афінної мас-спектрометрії, ко-імуно-преципітації, флуоресцентної мікроскопії, кондиційного нокаутування білків-партнерів та біохімічного блокування пренілювання). Було встановлено, що RABL3 задіяний в активації онкогену KRAS, порушення в якому спостерігають у великій кількості злоякісних новоутворень та у переважній більшості спонтанних випадків раку підшлункової залози. Так, мутантний RABL3 значно прискорював пренілювання KRAS, що є одніє з умов його активації.
Білок KRAS – один з трьох членів родини білків Ras (назва походить від об’єкту на якому вивчали даний ген – саркома щурів – rat sarcoma). Ці білки експресуються в усіх тканинах організму і задіяні у передачі сигналу, що спонукає клітину до росту і поділу (проліферації). Порушення Ras-сигналювання є одним із чинників неопластичної трансформації клітини, тому вони є потенційними онкогенами. Ключовим етапом активації KRAS є пренілювання – спеціальний ензим додає до протеїну молекулу ізопреноїду довжиною у 15 атомів вуглецю. Оскільки ізопреноїд – жиророзчинний (гідрофобний), він слугує своєрідним гачком, за допомогою якого білок KRAS чіпляється за внутрішню поверхню цитоплазматичної мембрани клітини, де KRAS бере участь у формуванні і сигнального комплексу безпосередньо під рецептором, який передає сигнал всередину клітини (у випадку KRAS – це тирозин-кіназний рецептор до ендотеліального ростового фактору, EGFR). Відтак, мутантний RABL3 пришвидшує темпи пренілювання KRAS, що в свою чергу веде до посилення проліферативного сигналу і може викликати перетворення клітини на ракову.
Загалом, це дуже міцна експериментальна робота – взірець мультидисциплінарного підходу: почалася з пошуку онкогенної мутації методами біоінформатики та статистики, продовжилася перевіркою її біологічних ефектів in vitro та in vivo та завершилася характеризацією наслідків мутації на молекулярному рівні в клітині. У підсумку дослідження допомогло виявити ще одне вразливе місце онкологічного захворювання – раку підшлункової залози, що в майбутньому дозволить розробити нові підходи до терапії цього злоякісного новоутворення. Причому ці результати будуть корисні не дише для членів родин зі спадковою формою ДАПЗ, а і для пацієнтів без родинної історії цього захворювання, оскільки ті ж самі мутації можуть виникати спонтанно.
Застосування системи геномного редагування CRISPR/Cas9 для швидкого моделювання канцерогенезу
 Канцерогенез – багатостадійний процес. В загальних рисах його поділяють на ініціацію, промоцію та прогресію. Кожний з етапів характеризується набуттям специфічних мутацій в генах, що відіграють ключову роль в розвитку пухлин, головно – прото-онкогенах та генах-супресорах пухлинного росту. Дослідження індивідуального внеску кожного з таких генів у «спільній справі», результатом якої є злоякісне новоутворення, є вкрай проблемним. На сьогодні існують дуже ефективні методи секвенування геному, настільки чутливі, що дозволяють визначати якісну та кількісну структуру генів окремої клітини. Такі методи активно застосовуються для дослідження гетерогенності популяції пухлинних клітин і є інформативними для вивчення пізніх стадій канцерогенезу. Проте, вони дають лише підсумкову картинку і не дозволяють прослідкувати історію мутацій і роль кожної з них на ранніх етапах неопластичної трансформації.
Канцерогенез – багатостадійний процес. В загальних рисах його поділяють на ініціацію, промоцію та прогресію. Кожний з етапів характеризується набуттям специфічних мутацій в генах, що відіграють ключову роль в розвитку пухлин, головно – прото-онкогенах та генах-супресорах пухлинного росту. Дослідження індивідуального внеску кожного з таких генів у «спільній справі», результатом якої є злоякісне новоутворення, є вкрай проблемним. На сьогодні існують дуже ефективні методи секвенування геному, настільки чутливі, що дозволяють визначати якісну та кількісну структуру генів окремої клітини. Такі методи активно застосовуються для дослідження гетерогенності популяції пухлинних клітин і є інформативними для вивчення пізніх стадій канцерогенезу. Проте, вони дають лише підсумкову картинку і не дозволяють прослідкувати історію мутацій і роль кожної з них на ранніх етапах неопластичної трансформації.
В наші дні з’явилася безпрецедентна можливість слідкувати за онкогенними мутаціями в режимі реального часу за допомогою…
Агенти впливу пухлини: злоякісні екзосоми
 Дедалі більшої уваги набуває відносно нещодавно описаний феномен дистанційної взаємодії пухлини зі здоровими тканинами організму через секрецію екзосом. Деякі злоякісні клітини здатні до виділення у міжклітинний простір та тілесні рідини наноскопічні везикули – кулясті мішечкі, оточені плазматичною мембраною, які можуть містити різноманітні активні речовини, здатні впливати на фізіологічні процеси, що проходять всередині нормальних клітин. Вчені припускають, що таким чином трансформовані клітини можуть впливати на оточуючі тканини і програмувати їхню діяльність на підтримання пухлини. Зокрема у 2012 році вчені Університету Штату Огайо продемонстрували здатність пухлин пригнічувати імунну відповідь за допомогою екзосом, що містили мікроРНК. А нещодавнє дослідження вчених Техаського Університету виявило взагалі неймовірні речі: біогенез мікроРНК може автономно проходити у везикулах, а потрапляння їх вмісту в нормальні епітеліальні клітини може призводити до їхнього неопластичного переродження. Фактично, отримано ще один доказ того, що «рак» може передаватися від клітини до клітини.
Дедалі більшої уваги набуває відносно нещодавно описаний феномен дистанційної взаємодії пухлини зі здоровими тканинами організму через секрецію екзосом. Деякі злоякісні клітини здатні до виділення у міжклітинний простір та тілесні рідини наноскопічні везикули – кулясті мішечкі, оточені плазматичною мембраною, які можуть містити різноманітні активні речовини, здатні впливати на фізіологічні процеси, що проходять всередині нормальних клітин. Вчені припускають, що таким чином трансформовані клітини можуть впливати на оточуючі тканини і програмувати їхню діяльність на підтримання пухлини. Зокрема у 2012 році вчені Університету Штату Огайо продемонстрували здатність пухлин пригнічувати імунну відповідь за допомогою екзосом, що містили мікроРНК. А нещодавнє дослідження вчених Техаського Університету виявило взагалі неймовірні речі: біогенез мікроРНК може автономно проходити у везикулах, а потрапляння їх вмісту в нормальні епітеліальні клітини може призводити до їхнього неопластичного переродження. Фактично, отримано ще один доказ того, що «рак» може передаватися від клітини до клітини.
«Молекулярний КітПес» викликає агресивний рак головного мозку
 Масштабне дослідження агресивного раку головного мозку, гліобластоми, дозволило виявити новий тип химерного онкогену, утвореного внаслідок хромосомної транслокації. Така генетична аномалія призводить до злиття воєдино двох протеїнів PTPRZ1 та MET із протилежними функціями, нагадуючи героя, а точніше героїв, популярного колись мультфільму «КітПес». Вчені сподіваюся, що їхнє відкриття може стати підґрунтям для розробки цілеспрямованої терапії проти цієї недуги. Але окрім відкриття теоретичної можливості запровадження таргетної терапії гліобластоми, дослідження також вказує на значний недолік сучасного терапевтичного підходу, довгостроковим результатом якого є прогресія злоякісного захворювання.
Масштабне дослідження агресивного раку головного мозку, гліобластоми, дозволило виявити новий тип химерного онкогену, утвореного внаслідок хромосомної транслокації. Така генетична аномалія призводить до злиття воєдино двох протеїнів PTPRZ1 та MET із протилежними функціями, нагадуючи героя, а точніше героїв, популярного колись мультфільму «КітПес». Вчені сподіваюся, що їхнє відкриття може стати підґрунтям для розробки цілеспрямованої терапії проти цієї недуги. Але окрім відкриття теоретичної можливості запровадження таргетної терапії гліобластоми, дослідження також вказує на значний недолік сучасного терапевтичного підходу, довгостроковим результатом якого є прогресія злоякісного захворювання.
Проблеми таргетної терапії та новітні підходи в лікуванні злоякісних новоутворень
Онкологічні захворювання є третьою за частотою причиною смертності пацієнтів в Україні та світі після серцево-судинних захворювань та цукрового діабету. Безперечно, онкологія становить серйозну загрозу здоров’ю населення, і тому процеси злоякісної трансформації являють неабиякий інтерес для фундаментально-біологічних досліджень. Зокрема, за останні роки були отримані широкі відомості про особливості генетики та метаболізму злоякісних новоутворень, розкрито каскади внутрішньоклітинних реакцій, що ведуть до канцерогенезу, встановлено функції багатьох сигнальних молекул, які безпосередньо реалізують ці каскади, активно досліджуються молекулярні механізми прогресії та метастазування пухлин. Результатом наукового поступу стала розробка великої кількості препаратів цілеспрямованої дії – так званої таргетної терапії раку. Але новітні підходи не змогли подолати онкологію повністю. У цій серії публікацій будуть наведені приклади того, як саме більш глибоке розуміння сигнальних каскадів канцерогенезу допомагає знаходити ефективніші способи лікування онкологічних захворювань. Також розглядається яким чином можливо обернути генетичні порушення в клітинах раку, які власне і є рушіями злоякісного перетворення, проти них самих.
Точкова мутація в каталітичній субодиниці фосфоінозитол-3-кінази веде до її рецептор-незалежної активації
 Група дослідників Case Western Reserve вперше описала новий шлях активації онкогенного каскаду, керованого фосфоінозитол-3-кіназою (PI3K). Отримані ними дані свідчать на користь того, що каталітична субодиниця кінази p110α набуває здатності вступати в протеїн-протеїнові взаємодії зі своїм функціональним партнером у разі виникнення точкової мутації – заміни залишку глутамату на лізин в 545-му положенні. За таких обставин p110α втрачає потребу у посередництві регуляторної субодиниці p85, попередньо активованій шляхом фосфорилюванням з боку рецепторної тирозинкінази, і може напряму взаємодіяти із фактором IRS1 (insulin reseptor substrate 1) і залучати його для допомоги у здійсненні фосфорилювання фосфоінозитолу (як показано на рисунку) і подальшій активації проліферативного каскаду PIK3/Akt. Таким чином мутована каталітична субодиниця p110α починає діяти як внутрішньоклітинний незалежний від рецептору онкоген.
Група дослідників Case Western Reserve вперше описала новий шлях активації онкогенного каскаду, керованого фосфоінозитол-3-кіназою (PI3K). Отримані ними дані свідчать на користь того, що каталітична субодиниця кінази p110α набуває здатності вступати в протеїн-протеїнові взаємодії зі своїм функціональним партнером у разі виникнення точкової мутації – заміни залишку глутамату на лізин в 545-му положенні. За таких обставин p110α втрачає потребу у посередництві регуляторної субодиниці p85, попередньо активованій шляхом фосфорилюванням з боку рецепторної тирозинкінази, і може напряму взаємодіяти із фактором IRS1 (insulin reseptor substrate 1) і залучати його для допомоги у здійсненні фосфорилювання фосфоінозитолу (як показано на рисунку) і подальшій активації проліферативного каскаду PIK3/Akt. Таким чином мутована каталітична субодиниця p110α починає діяти як внутрішньоклітинний незалежний від рецептору онкоген.
Ген PI3KCA, який кодує p110α, часто мутує на ранніх стадіях розвитку різноманітних пухлин, зокрема в раку молочної залози, прямої кишки та меланомі. Наразі відомі дві «гарячі точки мутації» в білку PI3KCA, одна з них знаходиться в альфа-спіралі в позиції 545, друга – в кіназному домені в позиції 1047. Вчені показали, що саме мутація в альфа-спіральному, а не кіназному, домені призводить до того, що каталітична субодиниця набуває здатності уникати інгібуючого впливу p85 та взаємодіяти із нефосфорильованим IRS1. Останній же стабілізує p110α (робить його недоступним для протеасоми) і, що найголовніше, спрямовує його до клітинної мембрани, де знаходяться залишки фосфоінозитолу. На моделі in vivo з використанням мишей із видаленим тимусом було продемонстровано абсолютна необхідність здаємодії p110α, який несе мутацію E545K, із IRS1 для експансії трансформованих клітин перещеплювальної пухлини.
Загалом, дані свідчать на користь того, що мутація E545K в альфа-спіралі каталітичної субодиниці фосфоінозиол-3-кінази веде до пришвидшення мітотичних циклів та посилення рухливості клітин, що відповідає прояву злоякісного метастазуючого фенотипу пухлини. В довершення дослідження вчені сконструювали пептид, що містив частину альфа-спірального домену із вищезгаданою сутацією, і ввели цей пептид в злоякісні клітини. Виявилося, що пептид конкурентно зв’язував IRS1 і не давав йому взаємодіяти із мутованою каталітичною субодиицею p110α, перериваючи таким чином онкогенний сигнал. На моделі in vivo це проявлялося як значне зменшення пухлинної маси ксенотрансплантату. Дослідники резюмують, що рентгеноструктурний аналіз комплексу мутантної форми p110α та IRS1 та подальший підбір низькомолекулярних сполук, що будуть здатні інгібувати утворення такого комплексу, є перспективним напрямом розробки таргетної терапії злоякісних новоутворень, які несуть мутацію E545K в альфа-спіральному домені каталітичної субодиниці фосфоінозитол-3-кінази.
Посилання
Вперше створено протеїн, який можна вмикати і вимикати відповідно до потреб дослідника

Вчені University of North Carolina at Chapel Hill School of Medicine сконструювали фермент, який можна вмикати і вимикати. Дослідники змогли ввести у структуру кінази саркоми Рауса (Src) новий домен, що уможливлює алостеричну модифікацію активності ферменту: у разі зв’язування із рапаміцином (також див. Mammalian target of rapamycin – mTOR) домен змінює конформацію і робить кіназу активною, і, навпаки, за відсутності рапаміцину кіназна активність блокується. Така модельна система була розроблена для дослідження ролі Src-кінази в переміщенні злоякісної клітини – процесі, завдяки якому відбувається метастазування пухлин.
Супер-енхансери – ахіллесова п’ята злоякісної клітини
 Не секрет, що системи сигнальних каскадів, які регулюють поведінку клітин, є напрочуд заплутаними і складними. Та розуміння того, як вони влаштовані, є конче необхідним, особливо, коли мова йде про перетворення нормальної клітини на ракову, оскільки цю інформацію можна використати для розробки підходів до терапії різних онкозахворювань. Після завершення секвенування геному людини на початку 2000-х відразу стартував інший проект під назвою ENCODE (Encyclopedia of DNA Elements project), покликаний дослідити значення тих послідовностей ДНК, які не кодують протеїни та РНК. У 2007 році були опубліковані результати цього дослідження, за якими виявилося, що в геномі людини міститься більше мільйона послідовностей, які відіграють роль перемикачів транскрипції – енхансерів, репресорів та інсуляторів. Попри більш, ніж достатню інформативність дослідження, воно також ставило перед вченими завдання, незбагненне за обсягом: описати роль кожного з цих елементів у нормальному розвитку та канцерогенезі.
Не секрет, що системи сигнальних каскадів, які регулюють поведінку клітин, є напрочуд заплутаними і складними. Та розуміння того, як вони влаштовані, є конче необхідним, особливо, коли мова йде про перетворення нормальної клітини на ракову, оскільки цю інформацію можна використати для розробки підходів до терапії різних онкозахворювань. Після завершення секвенування геному людини на початку 2000-х відразу стартував інший проект під назвою ENCODE (Encyclopedia of DNA Elements project), покликаний дослідити значення тих послідовностей ДНК, які не кодують протеїни та РНК. У 2007 році були опубліковані результати цього дослідження, за якими виявилося, що в геномі людини міститься більше мільйона послідовностей, які відіграють роль перемикачів транскрипції – енхансерів, репресорів та інсуляторів. Попри більш, ніж достатню інформативність дослідження, воно також ставило перед вченими завдання, незбагненне за обсягом: описати роль кожного з цих елементів у нормальному розвитку та канцерогенезі.
Нове терапевтичне антитіло здатне розпізнавати онкопротеїн всередині клітини

Антиген спадкової пухлини Вільмса – WT1 – вже давно є перспективною ціллю таргетної терапії, проте досі не розроблено жодного ефективного підходу до даної наукової задачі. Зазначений протеїн є фактором транскрипції, який містить в своїй структурі цинкові пальці і керує морфогенезом урогенітальної системи. Мутації в гені WT1 спостерігають у разі родинної пухлини Вільмса (новоутворення нирки, що найчастіше спостерігаються у дітей). Також експресія даного гену супроводжує деякі типи раку молочної залози, серозної карциноми яєчника, мезотеліоми та декількох типів лімфом. У разі пухлини Вільмса WT1 виступає супресором пухлинного росту, який зазнає інактивуючої мутації, тоді як в інших неоплазіях WT1 може слугувати раково-ембріональним антигеном, бо зазвичай не експресується в клітинах дорослого організму. В обох випадках WT1 може слугувати ціллю для імунотерапії раку, проте, оскільки цей білок є виключно внутрішньоклітинним, такий підхід до останнього часу був не доступний.
Дослідницька група Sloan-Kettering Institute розробила моноклональне антитіло, назване ними ESK1, націлене на онкопротеїн WT1. Вони досягли розпізнавання антитілом процесованого пептиду WT1 (під кодовою назвою від перших трьох амінокислот – RMF) у складі молекули головного комплексу гістосумісності класу І (МНС І, точніше HLA-A0201), тобто вперше «змусили» антитіло – продукт В-клітини – виконувати функції Т-клітинного рецептора. Як каже керівник дослідження Cheng Liu: «ESK1 віщує зміну парадигми в галузі імунотерапії моноклональними антитілами. Наше дослідження демонструє, що терапевтичні антитіла більше не обмежена протеїнами-мішенями, що доступні на поверхні клітини, а можуть також бути націлені на білки, які перебувають всередині пухлинної клітини».
Успішні випробування in vitro на патологічному матеріалі, взятому від пацієнтів, хворих на гостру лімфобластну лімфому, та на мишачій моделі згаданого захворювання in vivo, довели ефективність антитіла ESK1 в боротьбі проти WT1-експресуючої лейкемії. Від початку антитіло проектувалося як вектор для цільової доставки токсичних агентів до неопластичних клітин. Проте, на приємний подив дослідників, антитіло виявилося токсичним для злоякісних клітини саме по собі. Загибель лейкемічних клітин спостерігалася як у випадку введення антитіла разом із Т-кіллерними клітиними (що спричинювало реакцію антитіло-залежної цитотоксичності), так і в разі додавання самого лише антитіла. Логічно, що основним недоліком такої терапії є те, що вона дієва лише щодо пацієнтів, які хворіють на WT1+, HLA-A0201+ пухлини . Але за словами авторів дослідження за рік в світі щонайменше з’являється 1 мільйон онкохворих, чиї пухлини експресують WT1, і додають, що розроблений ними метод можна прилаштувати для отримання терапевтичних моноклональних антитіл із схожим принципом дії, але з іншими специфічностями.
Посилання