Масштабне дослідження агресивного раку головного мозку, гліобластоми, дозволило виявити новий тип химерного онкогену, утвореного внаслідок хромосомної транслокації. Така генетична аномалія призводить до злиття воєдино двох протеїнів PTPRZ1 та MET із протилежними функціями, нагадуючи героя, а точніше героїв, популярного колись мультфільму «КітПес». Вчені сподіваюся, що їхнє відкриття може стати підґрунтям для розробки цілеспрямованої терапії проти цієї недуги. Але окрім відкриття теоретичної можливості запровадження таргетної терапії гліобластоми, дослідження також вказує на значний недолік сучасного терапевтичного підходу, довгостроковим результатом якого є прогресія злоякісного захворювання.
Масштабне дослідження агресивного раку головного мозку, гліобластоми, дозволило виявити новий тип химерного онкогену, утвореного внаслідок хромосомної транслокації. Така генетична аномалія призводить до злиття воєдино двох протеїнів PTPRZ1 та MET із протилежними функціями, нагадуючи героя, а точніше героїв, популярного колись мультфільму «КітПес». Вчені сподіваюся, що їхнє відкриття може стати підґрунтям для розробки цілеспрямованої терапії проти цієї недуги. Але окрім відкриття теоретичної можливості запровадження таргетної терапії гліобластоми, дослідження також вказує на значний недолік сучасного терапевтичного підходу, довгостроковим результатом якого є прогресія злоякісного захворювання.
Tag Archives: клональна еволюція
Українська протиракова вакцина на марші
На написання цієї статті мене підштовхнув новинний сюжет, який нещодавно з’явився у Фактах ICTV. В ньому розповідається про передову розробку українських вчених в галузі імунотерапії раку, що допомагає подовжити період безрецедивного виживання пацієнтів після хірургічного видалення пухлини. Наразі я пропоную переглянути сюжет, а далі перейти до безпосереднього обговорення того, що, власне, відбувається на молекулярному та клітинному рівні:
Проблеми таргетної терапії та новітні підходи в лікуванні злоякісних новоутворень
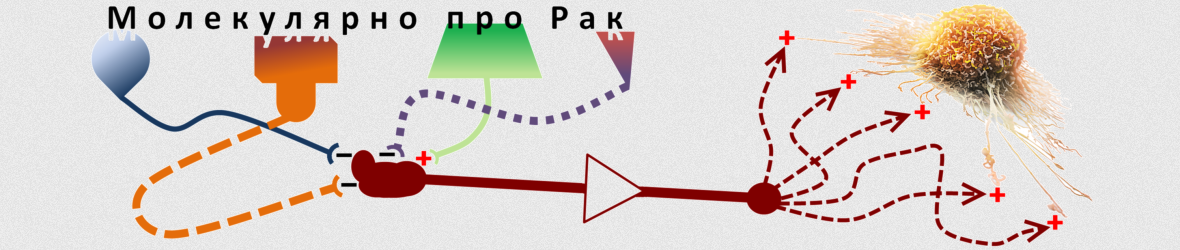
Онкологічні захворювання є третьою за частотою причиною смертності пацієнтів в Україні та світі після серцево-судинних захворювань та цукрового діабету. Безперечно, онкологія становить серйозну загрозу здоров’ю населення, і тому процеси злоякісної трансформації являють неабиякий інтерес для фундаментально-біологічних досліджень. Зокрема, за останні роки були отримані широкі відомості про особливості генетики та метаболізму злоякісних новоутворень, розкрито каскади внутрішньоклітинних реакцій, що ведуть до канцерогенезу, встановлено функції багатьох сигнальних молекул, які безпосередньо реалізують ці каскади, активно досліджуються молекулярні механізми прогресії та метастазування пухлин. Результатом наукового поступу стала розробка великої кількості препаратів цілеспрямованої дії – так званої таргетної терапії раку. Але новітні підходи не змогли подолати онкологію повністю. У цій серії публікацій будуть наведені приклади того, як саме більш глибоке розуміння сигнальних каскадів канцерогенезу допомагає знаходити ефективніші способи лікування онкологічних захворювань. Також розглядається яким чином можливо обернути генетичні порушення в клітинах раку, які власне і є рушіями злоякісного перетворення, проти них самих.
Використання комбінацій специфічних інгібіторів
У разі якщо застосування принципу синтетичної летальності для конкретного типу пухлини неможливе, існує інший спосіб підвищення ефективності таргетної терапії: використання одночасно двох терапевтичних молекул. Сигнальні каскади в клітині тісно переплетені між собою і почасти два окремих каскади можуть функціонувати як альтернативні у досягненні однієї клітинної відповіді, наприклад запуску проліферації. Часто непластичні клітини можуть обертати собі на користь такі особливості біології молекулярного сигналювання і в залежності від умов мікрооточення користуватися допоміжними шляхами онкогенезу для виживання під час застосування певного фармакологічного інгібітору, що націлений на основний шлях. Це допомагає клітинам раку «виграти час» для проходження всіх необхідних мутаційних подій, що ведуть до виникнення резистентності до застосовуваного препарату. Паралельне блокування основного і допоміжного онкогенних сигнальних шляхів можливе за умови одночасного використання двох таргетних препаратів, спрямованих проти протеїнів, що контролюють вищезгадані сигнальні шляхи. Кращий ефект лікування буде пов’язаний не лише із тим, що такий підхід дозволить знищувати більшу кількість клітин раку, але й призведе до зниження темпів клональної еволюції і таким чином знизить ризик рецидивів, оскільки розвинути резистентність відразу до двох медикаментозних препаратів раковій клітині складніше, ніж до одного.
Подвійний удар по хронічній мієлоїдній лейкемії
Останні розробки в галузі дизайну специфічних препаратів свідчать, що застосування комбінації таргетних терапевтичних молекул або препаратів із розширеною специфічністю (так званих multi-target drugs, детальніше читати тут) поступово викристалізовується у новий сучасний тренд фармакології. В цьому плані було б зовсім не коректно оминути увагою нові можливості, що відкриваються у лікуванні хронічної мієлоїдної лейкемії (ХМЛ). Згадана гематологічна неоплазія є хрестоматійним прикладом дослідження молекулярних механізмів канцерогенезу. ХМЛ – перший тип раку, в якому в середині 70-х рр. ХХ ст. було виявлено специфічне генетичне порушення: реципрокну хромосомну транслокацію між 9 та 22 хромосомами. Далі на початку 80-х доведено, що транслокація є причиною експресії онкогену – химерного протеїну Bcr-Abl, який викликає неконтрольований поділ лейкемічних клітин. І нарешті на початку 2000-х рр. було введено у клініку перший у світі таргетний препарат, що націлений на онкоген Bcr-Abl. Таким чином третє тисячоліття ознаменувалося початком ери таргетної терапії раку. Також саме на ХМЛ були досліджені і сформульовані такі поняття як нестабільність геному злоякісної клітини та клональна еволюція, і вперше постало питання резистетності раку до таргетної терапії.

Молекулярні основи хронічної мієлоїдної лейкемії. Реципрокна транслокація між 9 та 22 хромосомами t(9;22) є характерним генетичним маркером ХМЛ. Внаслідок обміну хромосомними сегментами відбувається злиття генів BCR та ABL на вкороченому аддукті 22-ї хромосоми (аддукт має спеціальну назву – філадельфіська хромосома). Продуктом злитого гену є химерний протеїн Bcr-Abl, який є постійно діючою тирозин-кіназою, яка шляхом фосфорилювання запускає сигнали до проліферації та виживання лейкемічної клітини. Джерело: Fröhling S., et al, Chromosomal Abnormalities in Cancer. The New England Journal of Medicine. 2008; 359:722-34